检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
2022年6月29日,中山大学丁俊军研究团队与js33333金沙线路检测李程研究团队在Cell Research上发表最新研究成果。该研究首次揭示了染色质结构因子CTCF除介导经典环挤压模型调控较短距离(小于2Mb)的染色质互作外,还可通过非经典相分离模型介导极长距离(大于10Mb)、跨染色质区室的染色质互作,并参与基因表达调控。

真核细胞的基因组通常长约2米,有序折叠在仅有10微米的细胞核中,形成包括染色质区室、染色质拓扑结构域(简称TAD)以及染色质环(简称Loop)等不同尺度的染色质结构 ADDIN EN.CITE ADDIN EN.CITE.DATA 1-3。不同程度的染色质结构异常会引起发育异常甚至是肿瘤的发生 ADDIN EN.CITE ADDIN EN.CITE.DATA 4-6。根据染色质状态和基因密度,染色质区室又可细分为A与B 两类。其中A 区室染色质状态相对开放,基因密度高,基因表达相对活跃;而B 区室中基因密度低,基因表达相对沉默。同类型的染色质间隔更易发生染色质互作,即AA互作或者BB互作,称为染色质区室化 ADDIN EN.CITE ADDIN EN.CITE.DATA 1。染色质区室化程度在细胞命运转变过程中常发生动态变化。经典染色质结构因子CTCF、cohesin蛋白介导的“环挤压”模型是目前领域内广泛认可的解释Loop及TAD形成的经典模型7-12,而介导区室化形成,尤其是介导基因广泛活跃转录的A间隔间的极长距离互作的形成机制,领域内仍缺乏解释。
在该项研究中,研究人员首先利用HiChIP技术,在小鼠胚胎干细胞中发现了CTCF参与A 区室之间的极长染色质互作;联合Hi-C数据,发现A区室间的互作随CTCF的敲除而减弱。由于CTCF结合位点的DNA序列方向分析显示CTCF参与的A区室间互作不符合经典的“环挤压”模型,研究团队猜测CTCF可能以一种独立于“环挤压”模型的方式介导A 区室间的互作。
在探究CTCF介导的极长距离互作的具体机制的过程中,研究团队首先发现了CTCF在细胞核内表现出相分离的特点,但体外纯化的蛋白很难形成液滴。这预示着可能存在其它因子辅助CTCF形成相分离;通过分析CTCF的互作蛋白,研究者不仅发现与CTCF直接发生蛋白间互作的RYBP具有最高比例的无序氨基酸,体内外均表现出相分离的特点,且进一步证明了CTCF的相分离依赖于RYBP;此外,通过分析RYBP敲除后的Hi-C及CTCF
HiChIP数据,研究团队发现CTCF介导的A 区室间互作也依赖于RYBP。为进一步探究CTCF的相分离在A 区室间互作形成中的作用,研究者首先通过敲除RYBP的方式破坏了CTCF的相分离以减弱A 区室间的互作;随后,在RYBP敲除细胞中融合表达CTCF与HNRNPA1 IDR以构建人工诱导CTCF相分离系统,进行Hi-C实验并进行数据分析,发现诱导CTCF相分离可显著恢复A 区室间互作;而利用1,6-hex进一步破坏造相后细胞中的相分离,Hi-C数据显示A 区室间的互作又重新减弱。从而证明了CTCF通过相分离的方式
调控A 区室间的互作。
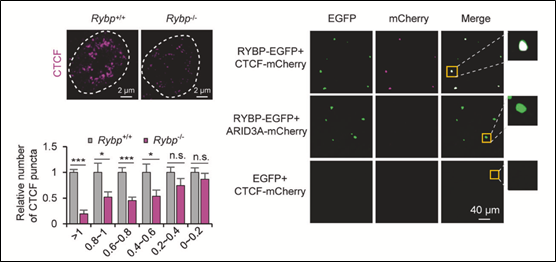
图-2. RYBP促进CTCF相分离调(摘自《Cell Research》发表论文)
研究者进一步证实了CTCF相分离可参与干细胞多能性调控。CTCF相分离倾向于在胚胎干细胞中富集,而在神经祖细胞中CTCF相分离能力则明显减弱;在小鼠胚胎干细胞中,通过敲除RYBP破坏CTCF相分离,RNA-seq数据显示大量临近A 区室间互作中心的基因表达下调,且下调的基因主要富集在细胞增殖相关的通路上;增殖实验结果表明,破坏CTCF相分离可显著降低胚胎干细胞的自我更新能力,而诱导CTCF相分离则显著恢复胚胎干细胞的自我更新能力;此外,在胚胎干细胞向神经祖细胞分化的过程中,诱导CTCF相分离则可抑制其分化。因此,CTCF相分离维持干细胞的自我更新,并抑制其向神经祖细胞分化。
研究者进一步解析了RYBP依赖的CTCF相分离与Polycomb body的关系。RYBP一直被认为是Polycomb 复合物的成分,抑制发育基因的表达 ADDIN EN.CITE ADDIN EN.CITE.DATA 13,14。而Polycomb 复合物的成分可聚集在Polycomb body中形成相分离,因此CTCF相分离本质上是否就是Polycomb body?研究者发现RYBP与CTCF在染色质上共富集的位点低富集Polycomb 复合物中的核心修饰酶RING1b,但高富集转录激活的组蛋白修饰;大部分RYBP与CTCF共聚集的puncta缺乏RING1b;干扰CTCF相分离与干扰Polycomb 复合物后的差异表达基因存在很大的差异。因此证明RYBP依赖的CTCF相分离与Polycomb body存在着明显的差异。
综上所述,该研究首次揭示了CTCF具有调控染色质区室间极长距离互作的新功能,并提出了CTCF通过RYBP依赖的相分离的方式调控染色质极长距离互作的新模型;同时揭示了操控CTCF的相分离可调控胚胎干细胞的多能性;从而在染色质区室层级上,填补了领域内染色质三维结构形成的重要理论空白。
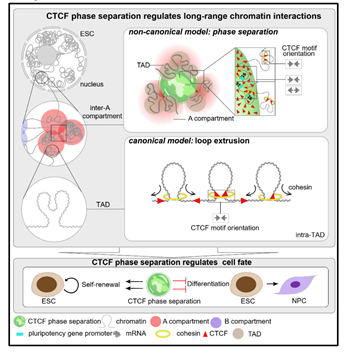
图-3. CTCF通过相分离调控染色质长距离互作的非经典模型(摘自《Cell Research》发表论文)
中山大学丁俊军教授与js33333金沙线路检测李程研究员是该研究的共同通讯作者,中山大学魏超博士、js33333金沙线路检测贾璐萌博士、以及中山大学博士生黄小娜、谭瑾为该研究成果的共同第一作者。清华大学博士生牛静完成了成像实验探针的制备,清华大学张奇伟教授、副研究员高军涛、js33333金沙线路检测孙育杰教授、博士生侯英萍对相关成像实验提供了重要建议和支持。
李程研究组链接:www.3d-genome.life
原文链接:https://doi.org/10.1038/s41422-022-00676-0
参考文献
1 Lieberman-Aiden, E. et al. Comprehensive mapping of long-range interactions reveals folding principles of the human genome. Science 326, 289-293, doi:10.1126/science.1181369 (2009).
2 Dixon, J. R. et al. Topological domains in mammalian genomes identified by analysis of chromatin interactions. Nature 485, 376-380, doi:10.1038/nature11082 (2012).
3 Rao, S. S. et al. A 3D map of the human genome at kilobase resolution reveals principles of chromatin looping. Cell 159, 1665-1680, doi:10.1016/j.cell.2014.11.021 (2014).
4 Weintraub, A. S. et al. YY1 Is a Structural Regulator of Enhancer-Promoter Loops. Cell 171, 1573-+, doi:10.1016/j.cell.2017.11.008 (2017).
5 Lupianez, D. G. et al. Disruptions of topological chromatin domains cause pathogenic rewiring of gene-enhancer interactions. Cell 161, 1012-1025, doi:10.1016/j.cell.2015.04.004 (2015).
6 Flavahan, W. A. et al. Insulator dysfunction and oncogene activation in IDH mutant gliomas. Nature 529, 110-+, doi:10.1038/nature16490 (2016).
7 Rao, S. S. P. et al. Cohesin Loss Eliminates All Loop Domains. Cell 171, 305-+, doi:10.1016/j.cell.2017.09.026 (2017).
8 Fudenberg, G. et al. Formation of Chromosomal Domains by Loop Extrusion. Cell Rep 15, 2038-2049, doi:10.1016/j.celrep.2016.04.085 (2016).
9 Kim, Y., Shi, Z., Zhang, H., Finkelstein, I. J. & Yu, H. Human cohesin compacts DNA by loop extrusion. Science 366, 1345-1349, doi:10.1126/science.aaz4475 (2019).
10 Davidson, I. F. et al. DNA loop extrusion by human cohesin. Science 366, 1338-1345, doi:10.1126/science.aaz3418 (2019).
11 Tang, Z. H. et al. CTCF-Mediated Human 3D Genome Architecture Reveals Chromatin Topology for Transcription. Cell 163, 1611-1627, doi:10.1016/j.cell.2015.11.024 (2015).
12 Lomvardas, S. et al. Interchromosomal interactions and olfactory receptor choice. Cell 126, 403-413, doi:10.1016/j.cell.2006.06.035 (2006).
13 Neira, J. L. et al. The Transcriptional Repressor RYBP Is a Natively Unfolded Protein Which Folds upon Binding to DNA. Biochemistry-Us 48, 1348-1360, doi:10.1021/bi801933c (2009).
14 Gao, Z. et al. PCGF homologs, CBX proteins, and RYBP define functionally distinct PRC1 family complexes. Mol Cell 45, 344-356, doi:10.1016/j.molcel.2012.01.002 (2012).