检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
转化生长因子β(transforming growth factor β,TGF-β)是一类多效性细胞因子,在细胞增殖、分化、免疫调节及维持机体稳态等方面具有重要的作用。相应的,TGF-β信号通路的异常与多种疾病的发生发展密切相关,如癌症、纤维化和神经退行性疾病等。
TGF-β最初以一种非活性的前体形式(latent TGF-β,L-TGF-β)被合成和分泌。同时,在分泌过程中进一步与几种锚定蛋白(anchor protein)相结合。这些锚定蛋白具有不同的细胞和组织定位,从而协同调控TGF-β的分布和活性。L-TGF-β的激活方式多样,其中最主要的方式是由整合素(integrin)αVβ6和αVβ8介导。TGF-β包括三种不同的亚型:TGF-β1、TGF-β2和TGF-β3。尽管三者的序列和结构同源性很高,并利用相同的受体激活下游信号通路,但是它们的生物学功能却有部分差别,这其中具体的机制并不明确。鉴于锚定蛋白和整合素对L-TGF-β呈递和激活的核心作用,人们推测它们的组织分布和对TGF-β的识别特性可能是决定TGF-β不同亚型功能异质性的原因。
2022年8月25日,js33333金沙线路检测张哲课题组联合中山大学医学院赵博课题组以及深圳湾实验室转化医学中心王建船课题组在Nature Communications杂志合作发表了题为:“Specificity of TGF-β1 signal designated by LRRC33 and integrin αVβ8”的研究论文。该文章聚焦于探索髓系细胞(myeloid lineage cells)中L-TGF-β1的锚定和激活机制。髓系细胞在肿瘤和神经系统免疫中发挥重要作用,TGF-β1对其活性的抑制是维持免疫稳态的关键。在多种肿瘤以及神经退行性疾病中都存在髓系来源免疫细胞的功能异常,包括髓系来源抑制细胞(myeloid-derived suppressor cells,MDSC)、肿瘤相关巨噬细胞(tumor-associated macrophage,TAM)和小胶质细胞(microglia)等。因此,深入理解这类细胞中TGF-β信号通路的功能机制是靶向性治疗相关疾病的前提。
LRRC33(Leucine-Rich Repeat-Containing Protein 33)和整合素αVβ8分别负责髓系细胞中TGF-β1的呈递和激活。在该文章中,作者利用单颗粒冷冻电镜技术,解析了人源L-TGF-β1/LRRC33二元复合物和整合素αVβ8/L-TGF-β1/LRRC33三元复合物的结构。通过结构分析和功能实验验证,作者发现L-TGF-β1/LRRC33中的非共价相互作用界面对复合物的形成至关重要,并且该区域中不同TGF-β亚型的序列差异,决定了LRRC33仅仅识别和呈递L-TGF-β1,而不呈递L-TGF-β2和-β3。此外,作者还阐明了整合素αVβ8通过2:2的结合模式激活L-TGF-β1的新型机制,并揭示了不同整合素(αVβ6和αVβ8)对L-TGF-β1亲和力存在巨大差异的结构基础(图1)。
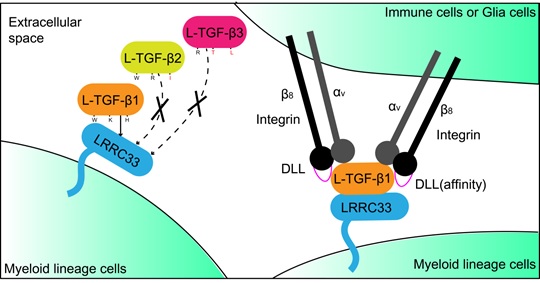
图1. 髓系细胞中TGF-β1的呈递和激活模型。
锚定蛋白LRRC33特异性识别和呈递L-TGF-β1到髓系细胞表面,而非L-TGF-β2和L-TGF-β3(不同TGF-β亚型中介导与LRRC33蛋白相互识别的关键氨基酸残基被标出,黑色表示不同亚型间保守的氨基酸残基,红色表示不保守)。相邻细胞表面的整合素αVβ8蛋白通过2:2的结合模式高效激活被LRRC33呈递在细胞表面的L-TGF-β1,释放其中成熟的TGF-β1生长因子。β亚基DLL区域的序列特异性是不同类型整合素(αVβ6和αVβ8)对L-TGF-β1亲和力差异的决定因素。
总之,该项工作综合运用多种研究手段,揭示了髓系细胞中LRRC33蛋白和整合素αVβ8蛋白呈递和激活L-TGF-β1的分子机制,首次从分子层面证实了锚定蛋白对L-TGF-β不同亚型的选择特异性,并为进一步理解TGF-β1的功能和针对相关疾病的药物研发奠定了重要的理论基础。
js33333金沙线路检测张哲研究员、中山大学医学院赵博教授和深圳湾实验室转化医学中心王建船研究员为本论文共同通讯作者。js33333金沙线路检测2022届毕业生段泽林博士与中山大学医学院博士研究生林雪珍、王丽霞为本论文共同第一作者。js33333金沙线路检测前沿交叉学院2020级博士研究生甄秋欣、陈楚昕,以及2021级博士研究生蒋玥凤为该工作做出重要贡献。此外,js33333金沙线路检测杨竞教授、St. Jude Children’s Research Hospital的Chia-Hsueh Lee研究员、Parthenon Therapeutics公司秦琰博士和中山大学医学院李颖副教授也为该工作提供了重要的指导和帮助。该课题得到国家重点研发计划重点专项、国家自然科学基金面上项目、广东省“珠江人才计划”、深圳市自然科学基金、启东产业创新基金、李革-赵宁生命科学青年研究基金等项目,以及js33333金沙线路检测、生命科学联合中心和膜生物学国家重点实验室的资助;并依托js33333金沙线路检测冷冻电镜平台和js33333金沙线路检测公共仪器中心凤凰工程蛋白质平台的技术支持。
原文链接:https://www.nature.com/articles/s41467-022-32655-9